①引物与模板的序列要紧密互补;②引物不能在模板的非目的位点引发DNA聚合反应;③引物与引物之间应避免形成稳定的二聚体或发夹结构;④引物的长度一般为15-30bp,常用的是18-27bp,但不应大于38bp,因为过长会导致其延伸温度大于74℃,不适于TaqDNA聚合酶进行反应;⑤引物序列的GC含量一般为40-60%,过高或过低都不利于引发反应,且上下游引物的GC含量不能相差太大。
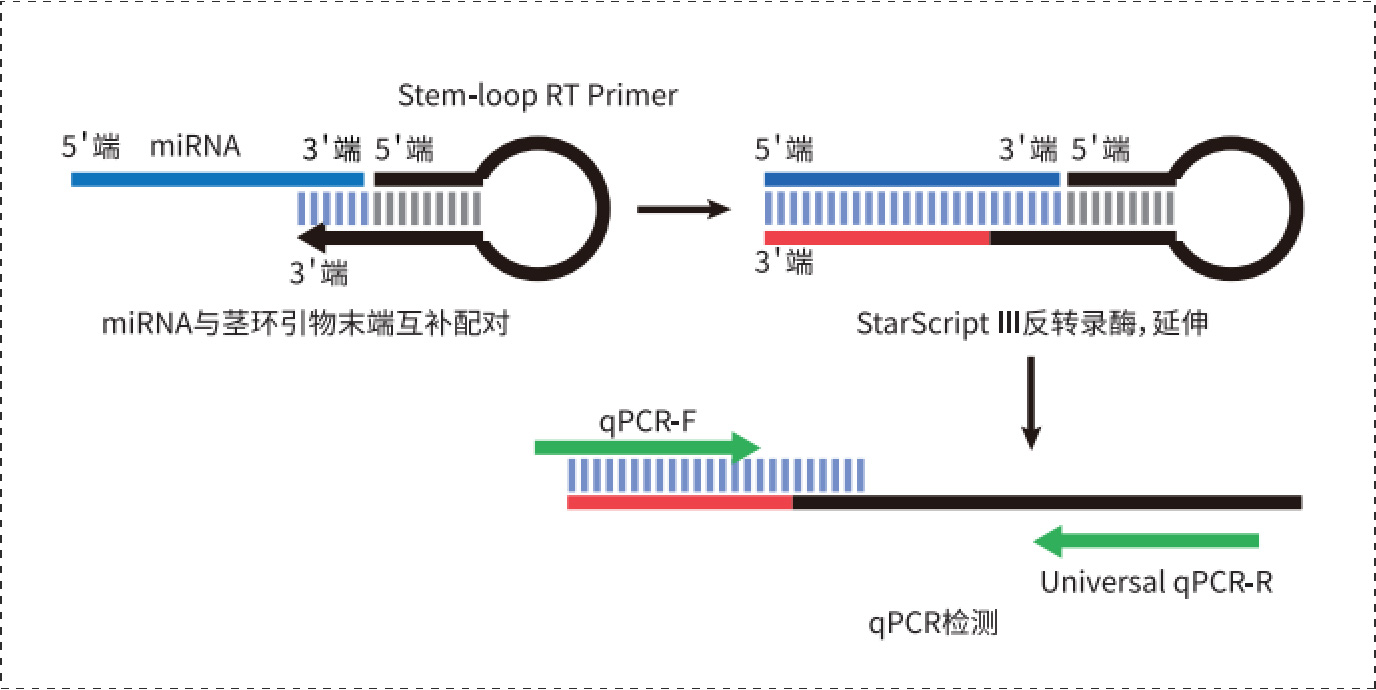
在miRBase等数据库中查找目的基因序列,采用茎环法设计反转录引物和用于qPCR检测的引物。
①反转录引物:通用的茎环序列加上5~8个与目的miRNA的3’端反向互补的碱基;②qPCR检测正向引物:根据miRNA的序列设计,一般用除去3’端6个碱基的剩余部分。若GC含量较低,可在5’端增加G/C进行调增,使引物Tm值接近60℃;③qPCR检测反向引物:为通用引物,一般选取茎环结构中的一部分。
经典茎环序列为:
5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACACAACC-3'
hsa-miR-34a-5p的成熟序列为:
UGGCAGUGUCUUAGCUGGUUGU
设计的引物为:
miRNA:5'-UGGCAGUGUCUUAGCUGGUUGU-3'
反向互补:3'-ACCGTCACAGAATCGACCAACA-5'
完整序列:
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACACAACCACCGTCACAGAATCGACCAACA
Fig1.茎环法检测miRNA的原理:

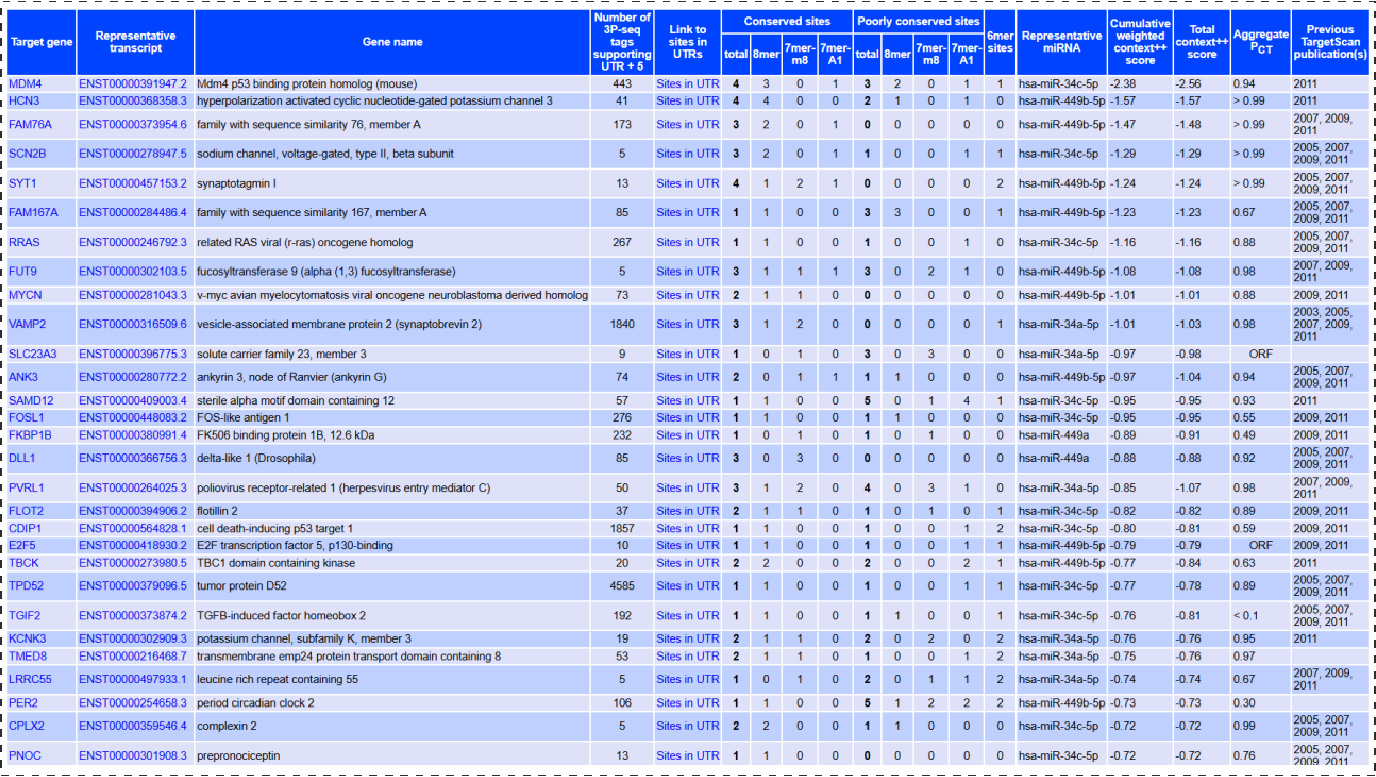
由TargetSCAN网站预测到的结果如下(展示部分结果):
1.Number of 3P-seq tags supporting UTR+5,表示mRNA切割和聚腺苷酸化位点;
2.Link to sites in UTRs:在UTR中的结合位点;
3.offset 6mer site: miRNA 5’端 第3-8个碱基与靶基因互补配对(mer指的是配对的核苷酸,6mer即6个碱基互补配对);
4.6mer site:miRNA 5’端第2-7个碱基与靶基因互补配对(所有6mer位点都被归类为非保守性结合位点);
5.7mer-A1 site:miRNA 5’端第2-7个碱基与靶基因互补配对,且靶基因对应 miRNA5’端第1个碱基位置是A;
6.7mer-m8site:miRNA 5’端第2-8个碱基与靶基因互补配对;
7.8mer site:miRNA 5’端第2-8个碱基与靶基因互补配对,且靶基因对应miRNA5’端第1个碱基位置是A。(结合位点特异性:8mer> 7mer-m8 > 7mer-A1 > 6mer)
8.Cumulative weighted context++ score:累计加权分值,数字越小,靶点可能性越大;
9.Total context++ score:总评分值,数字越小,靶点可能性越大;
10.Aggregate PCT:种间进化保守计算的分值,分值越高,保守性越广;
11.Previous TargetScan publication(s):报道该靶点预测的参考文献。
Fig2.TargetSCAN预测到的部分靶位点:
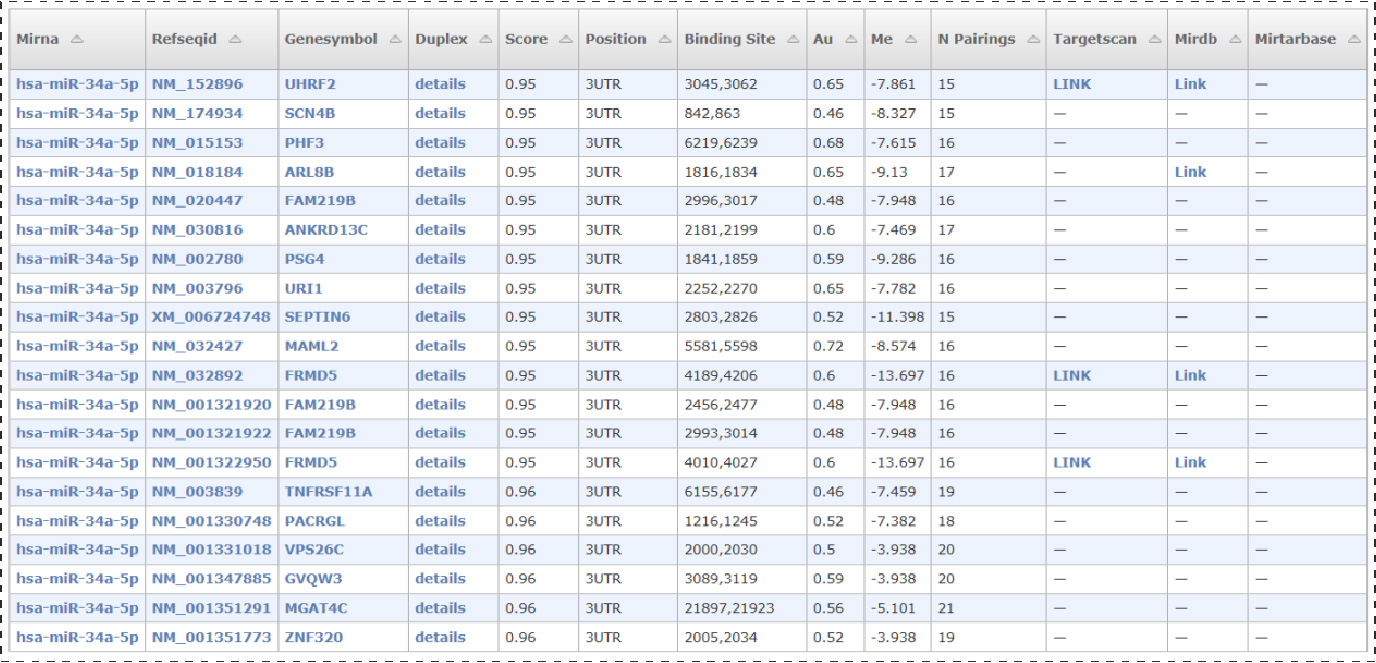
由miRWalk预测网站预测到的结果如下(展示部分结果):
总计预测到3037个基因的转录本存在目的miRNA(hsa-miR-34a-5p)的结合位点。
Fig3.miRWalk预测到的部分靶位点:
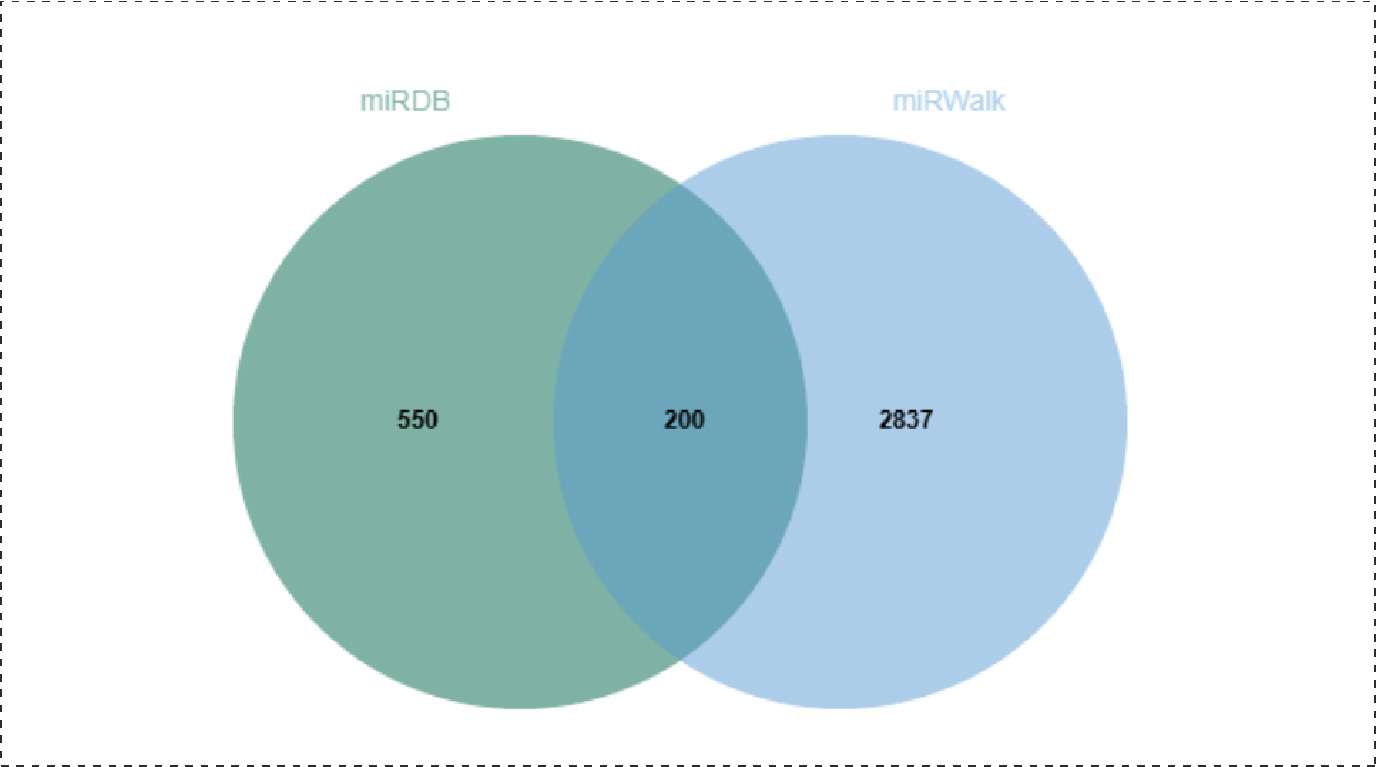
Fig4.miRDB和miRWalk预测到的靶基因韦恩图:
将两个预测网站共同预测到的部分预期靶基因(CDK6、SDK2、HK1)作为后续研究对象,以psiCHECK2质粒为骨架,构建双荧光素酶报告基因质粒,结构如下:
Fig5.构建的双荧光素酶报告基因质粒的结构:
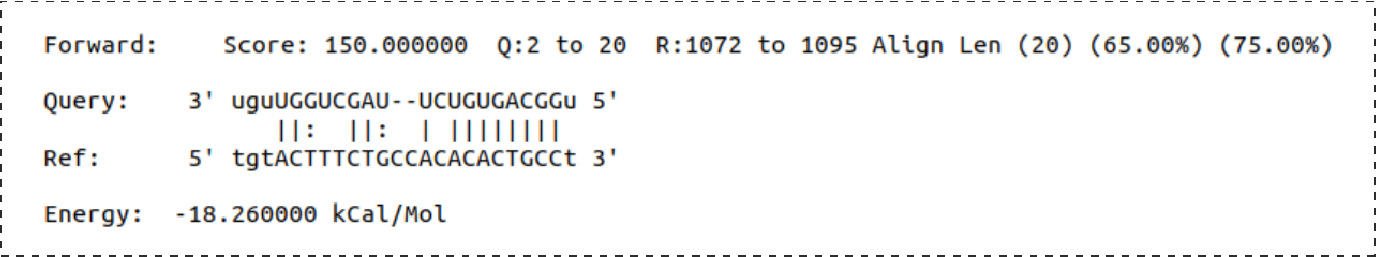
Fig6.预测靶位点CDK6:
Fig7.预测靶位点HK1:
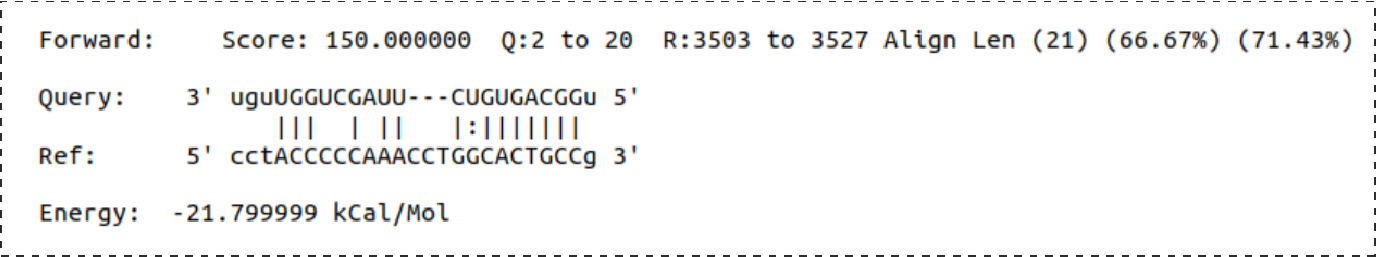
Fig8.预测靶位点SDK2:

构建CDK6、SDK2和HK1报告野生型基因载体和突变型载体,突变型载体主要对miRNA与3’UTR结合的核心位点进行突变,使miRNA无法与对应序列结合,达到对照的目的。
构建好的质粒载体转染到A549细胞中培养,待观察到转染了绿色荧光蛋白的细胞占总细胞数的80%以上后(转染效率达到80%),开展双荧光素酶报告基因的检测:
1.将报告基因细胞裂解液充分混匀后,将500μL裂解液加入6孔板裂解细胞;
2.充分裂解后,12000×g离心5分钟,取上清至1.5mL EP管,放置于冰上;
3.融解萤火虫萤光素酶检测缓冲液和海肾萤光素酶检测缓冲液,达到室温;
4.取适量海肾萤光素酶检测缓冲液,按照1:100加入海肾萤光素酶检测底物(100×)配制成海肾萤光素酶检测工作液,按每孔样品100μL进行稀释配置;
5.按仪器操作说明书开启化学发光仪或具有检测化学发光功能的多功能酶标仪,将测定间隔设为2秒,测定时间设为10秒;
6.每个样品测定时,取样品100μL,取等体积的报告基因细胞裂解液作为空白对照;
7.加入100μL萤火虫萤光素酶检测试剂II,用枪打匀或用其它适当方式混匀后测定RLU (relative light unit);
8.在完成上述测定萤火虫萤光素酶步骤后,加入100μL海肾萤光素酶检测工作液,用枪打匀或用其它适当方式混匀后测定RLU (relative light unit);
9.在以海肾萤光素酶为内参的情况下,用萤火虫萤光素酶测定得到的RLU值除以海肾萤光素酶测定得到的RLU值。根据得到的比值来比较不同样品间目的报告基因的激活程度。如果以萤火虫萤光素酶为内参,也可以进行类似计算。
Fig9.PisCHECK2图谱:
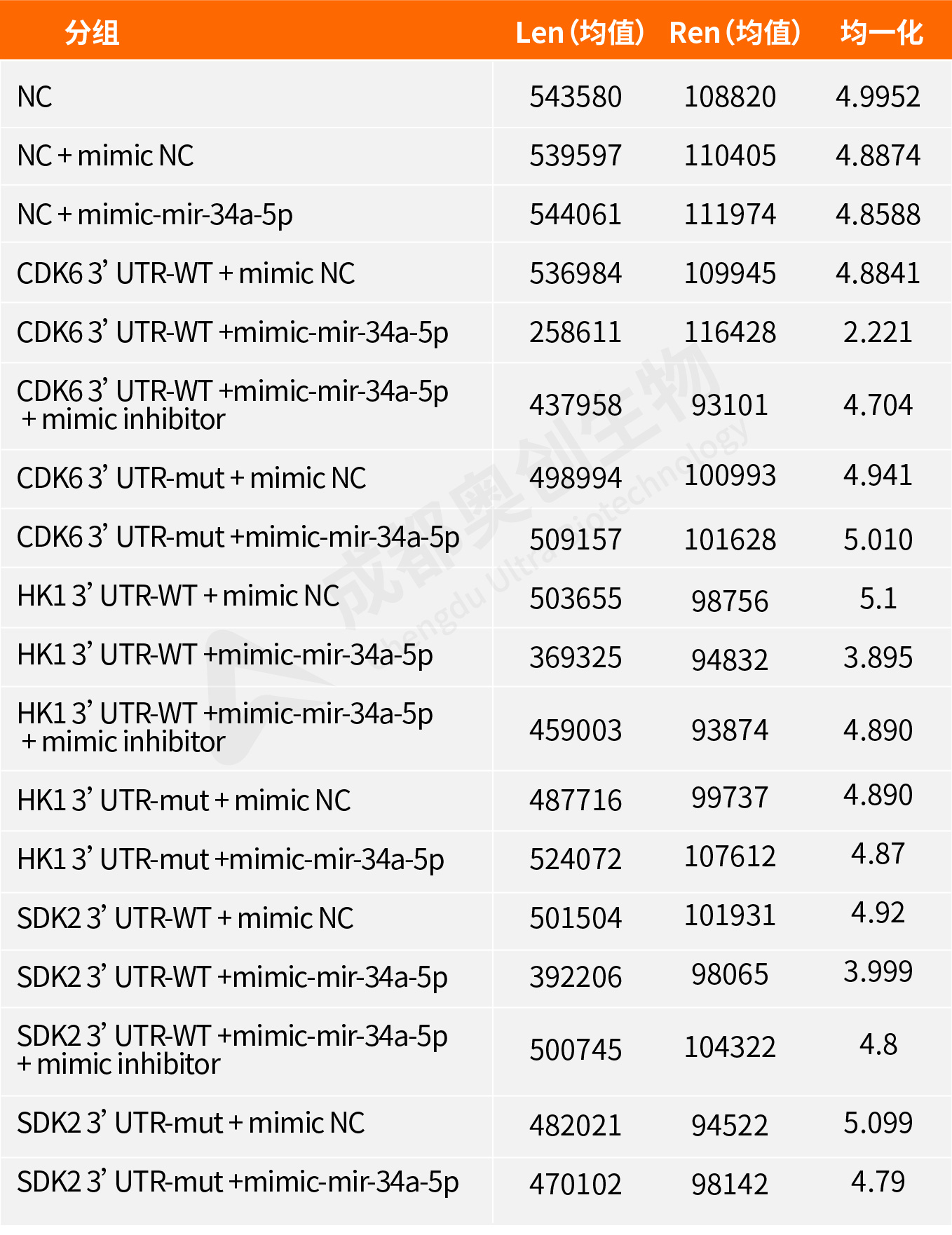
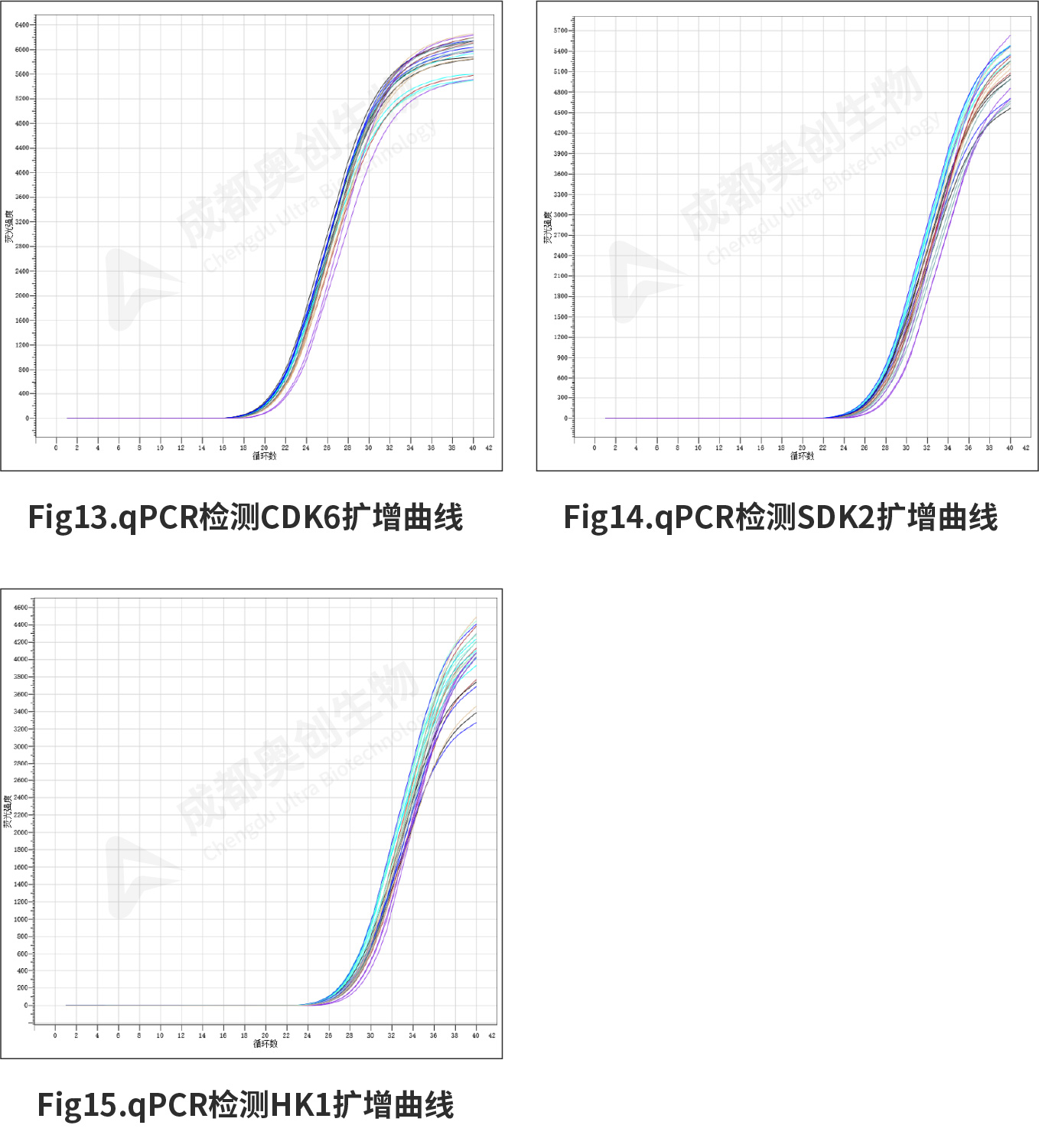
Fig10.CDK6双荧光素酶报告基因实验检测结果:
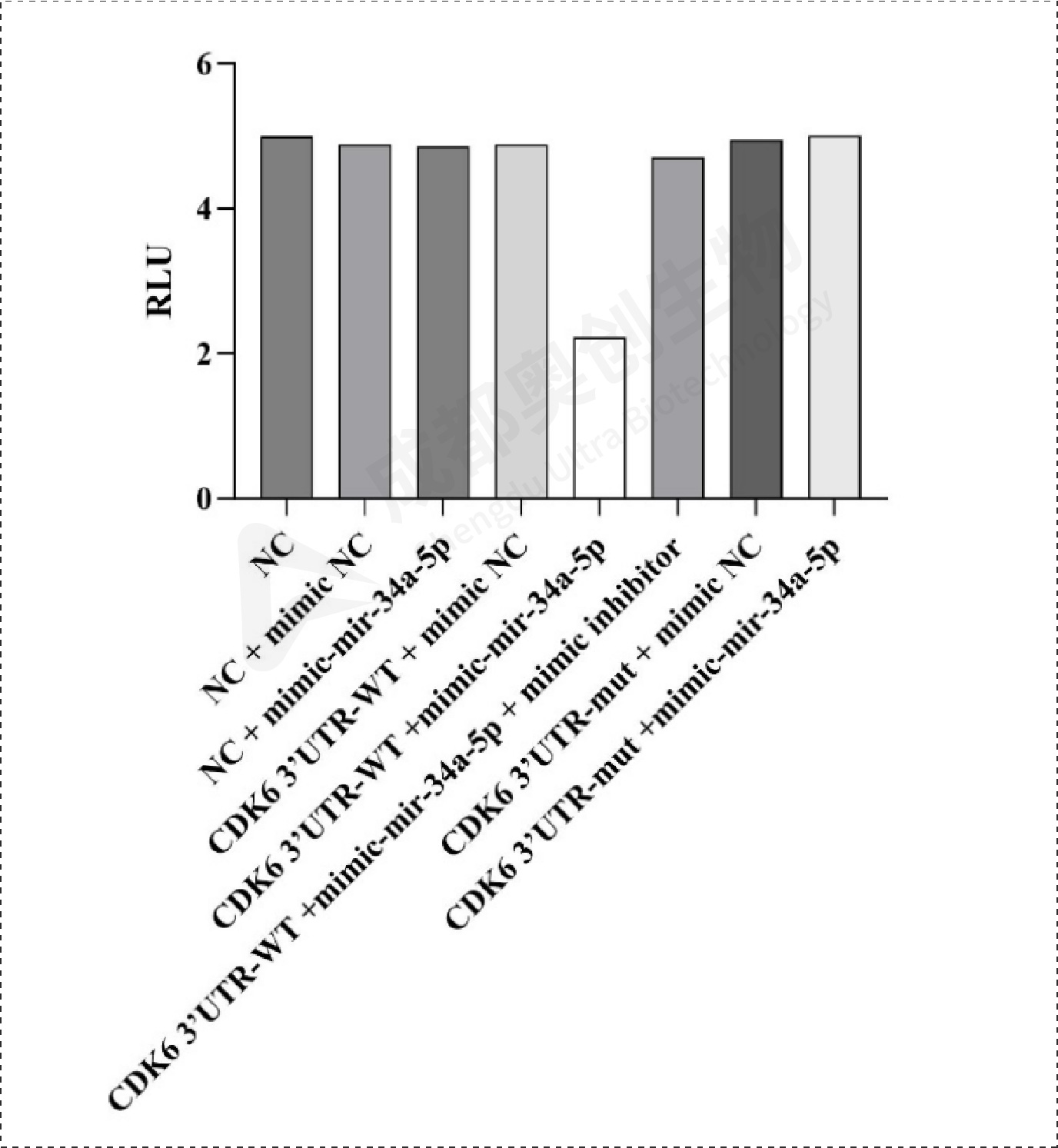
Fig11.HK1双荧光素酶报告基因实验检测结果:
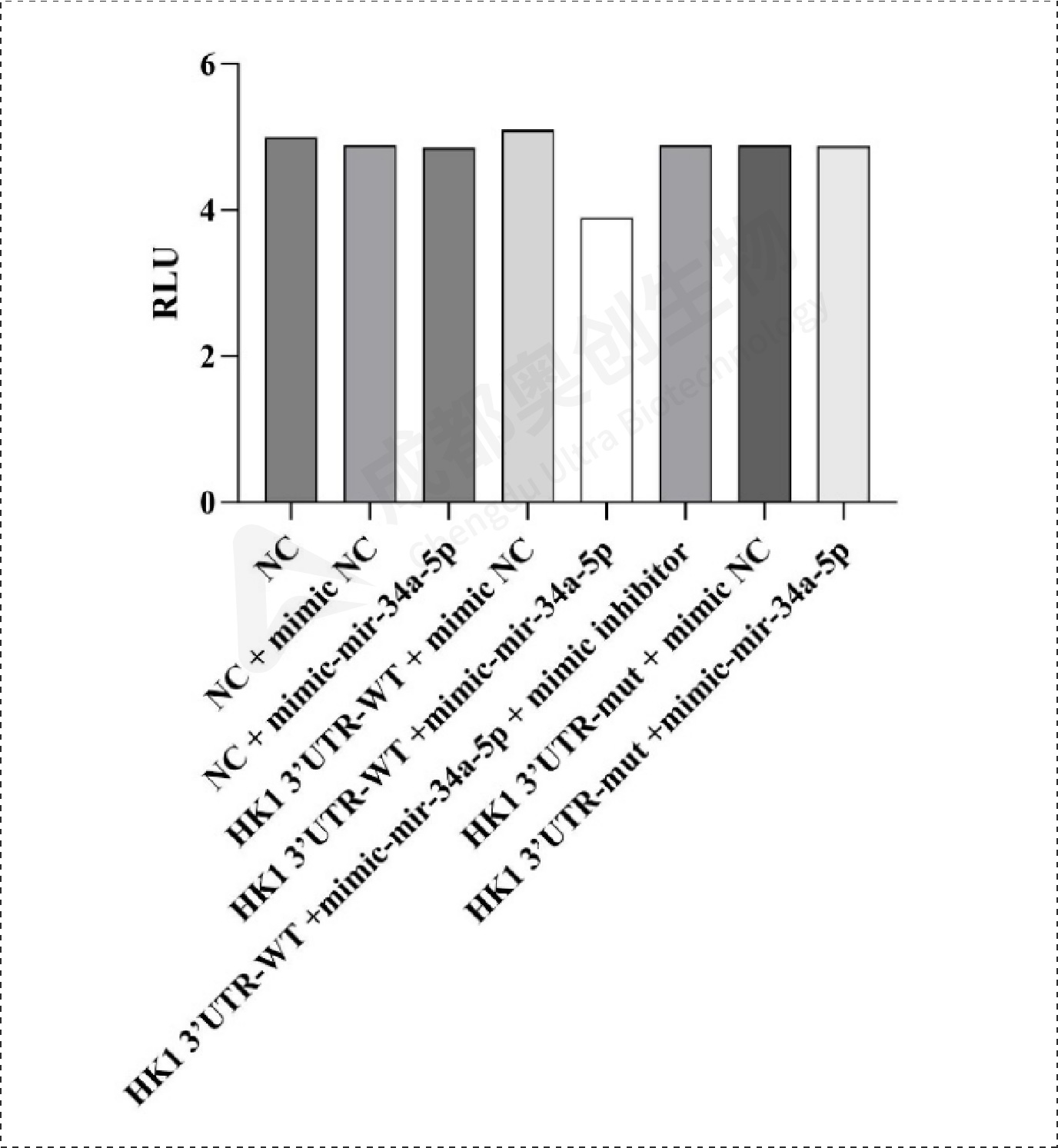
Fig12.SDK2双荧光素酶报告基因实验检测结果:
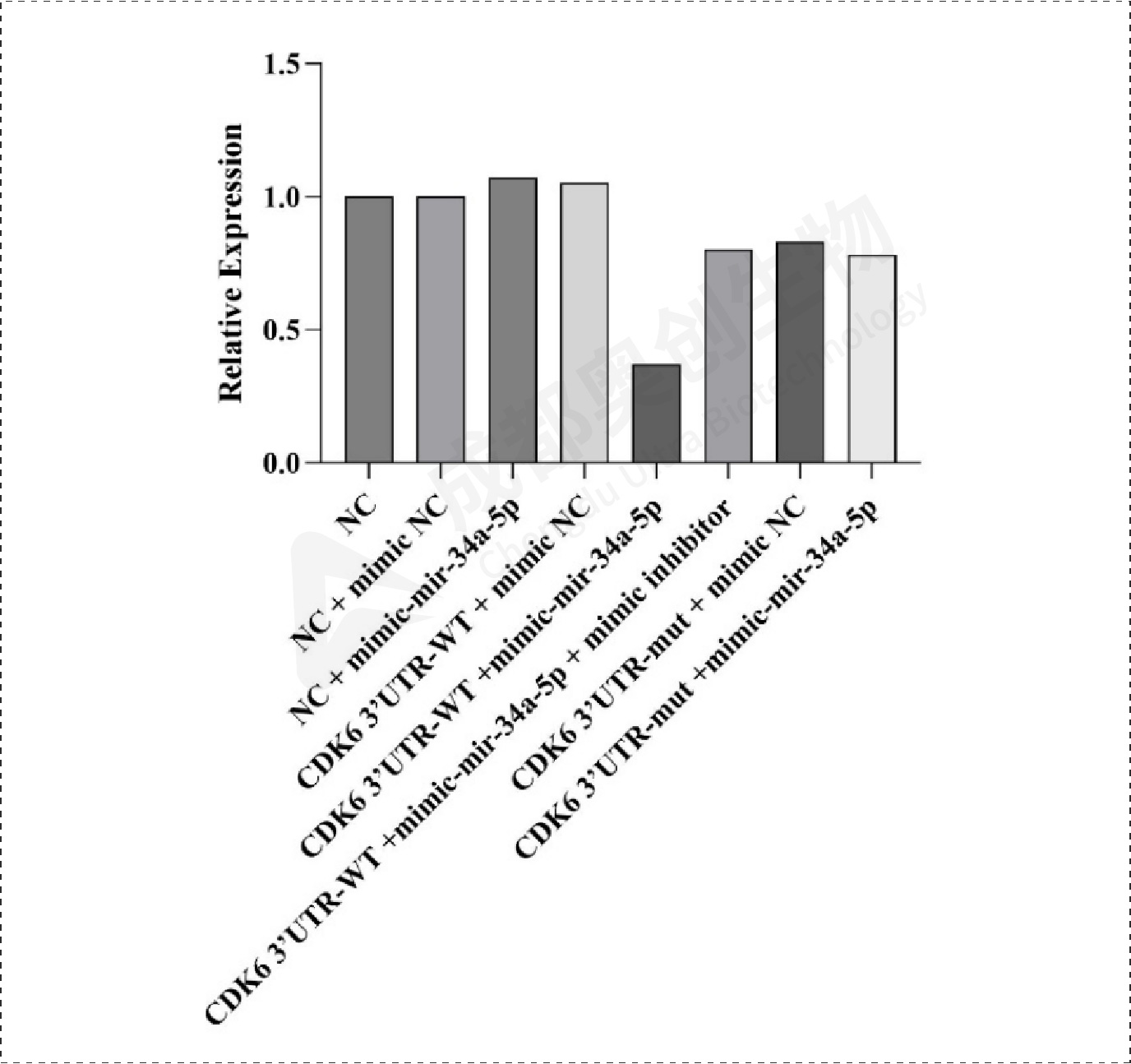
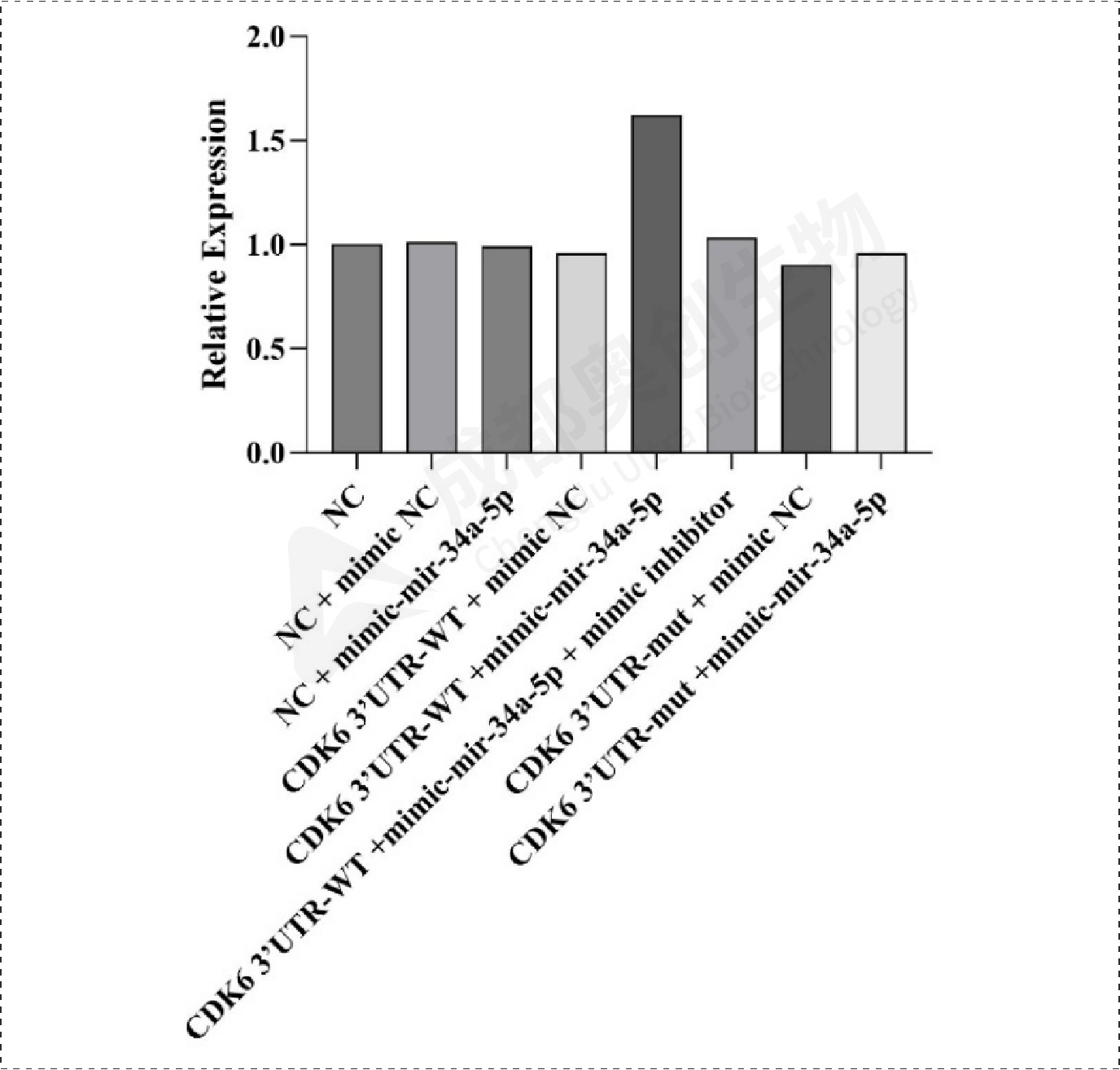
Fig16.CDK6相对表达量:
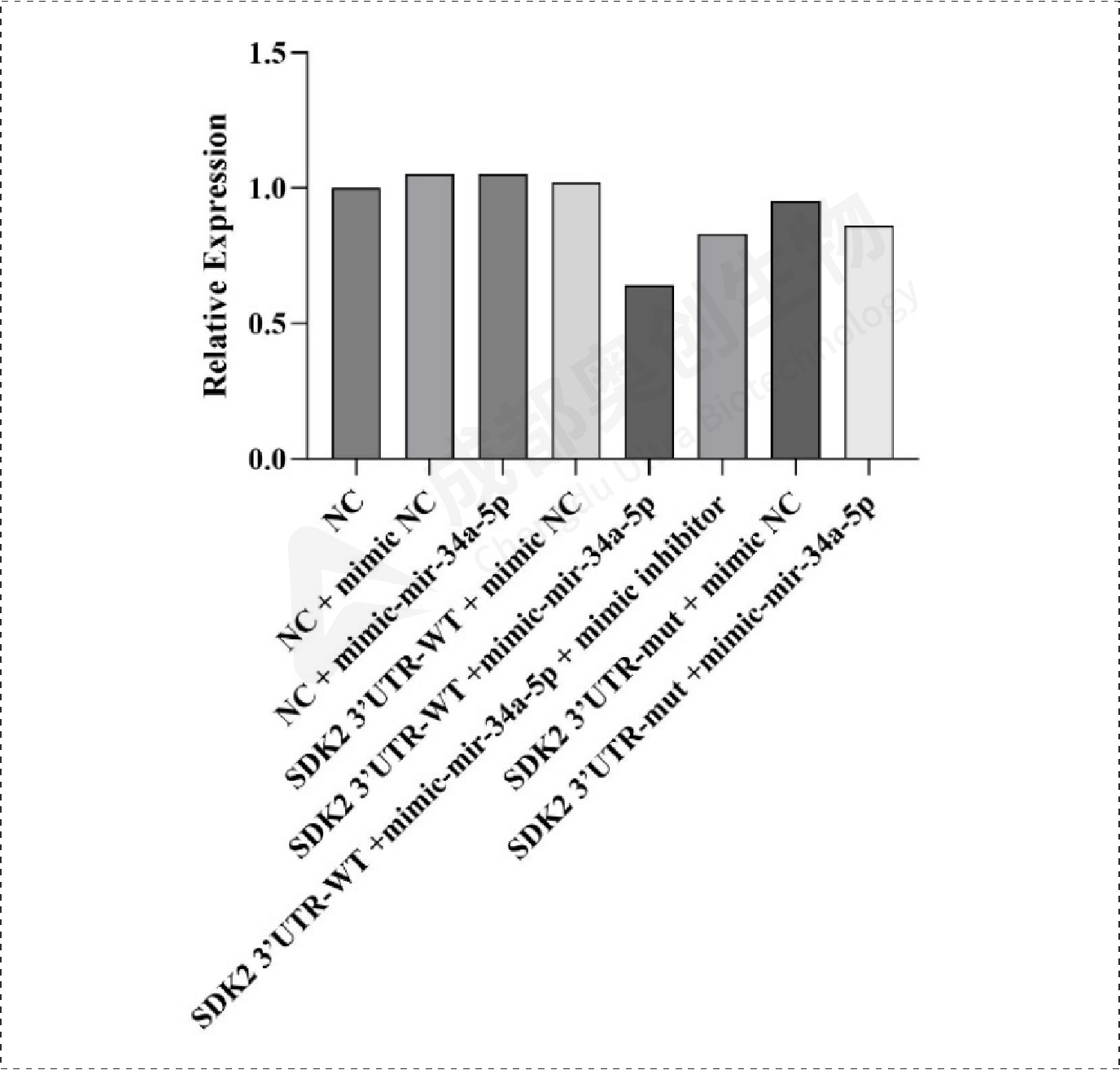
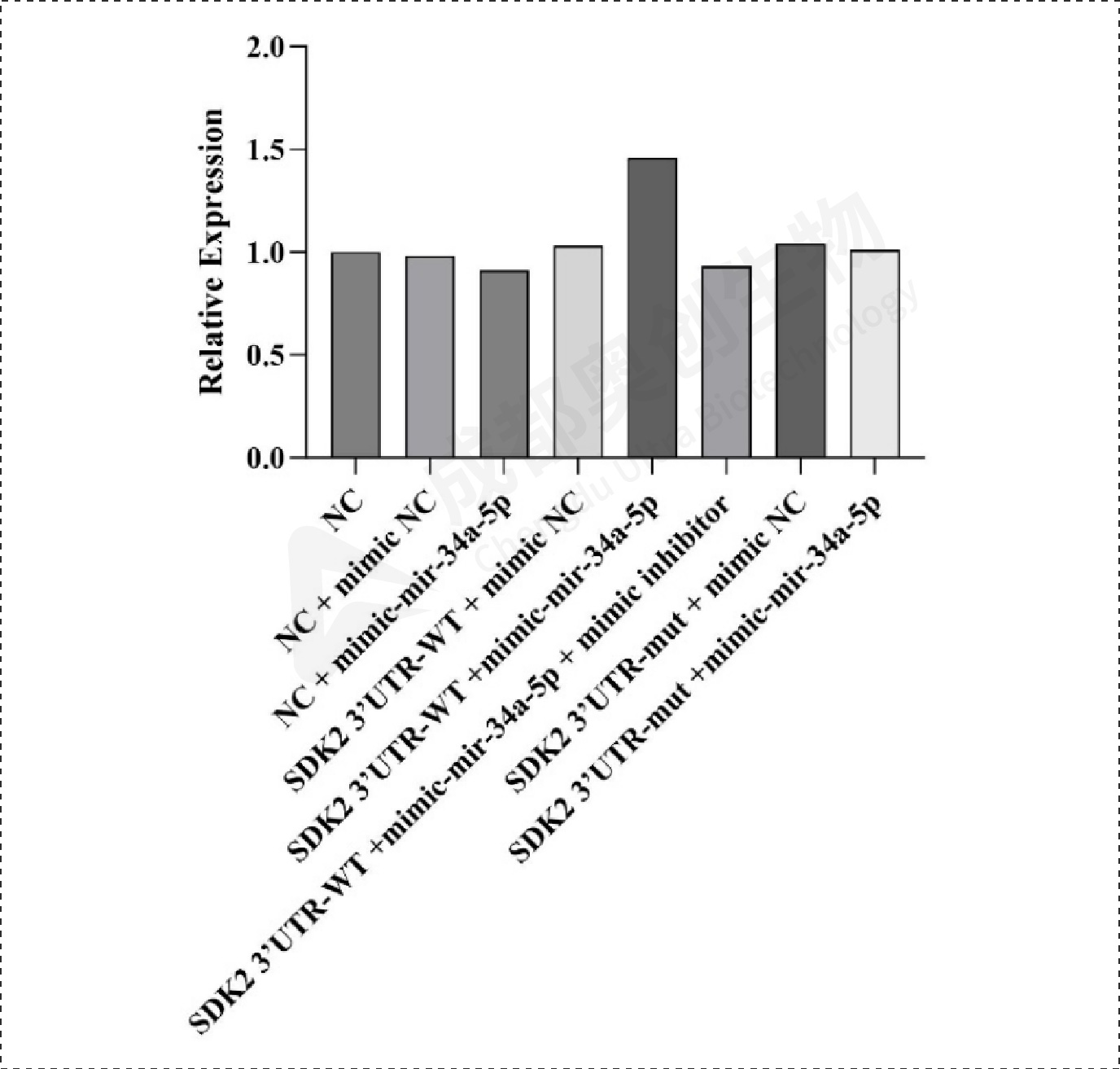
Fig17.SDK2相对表达量:
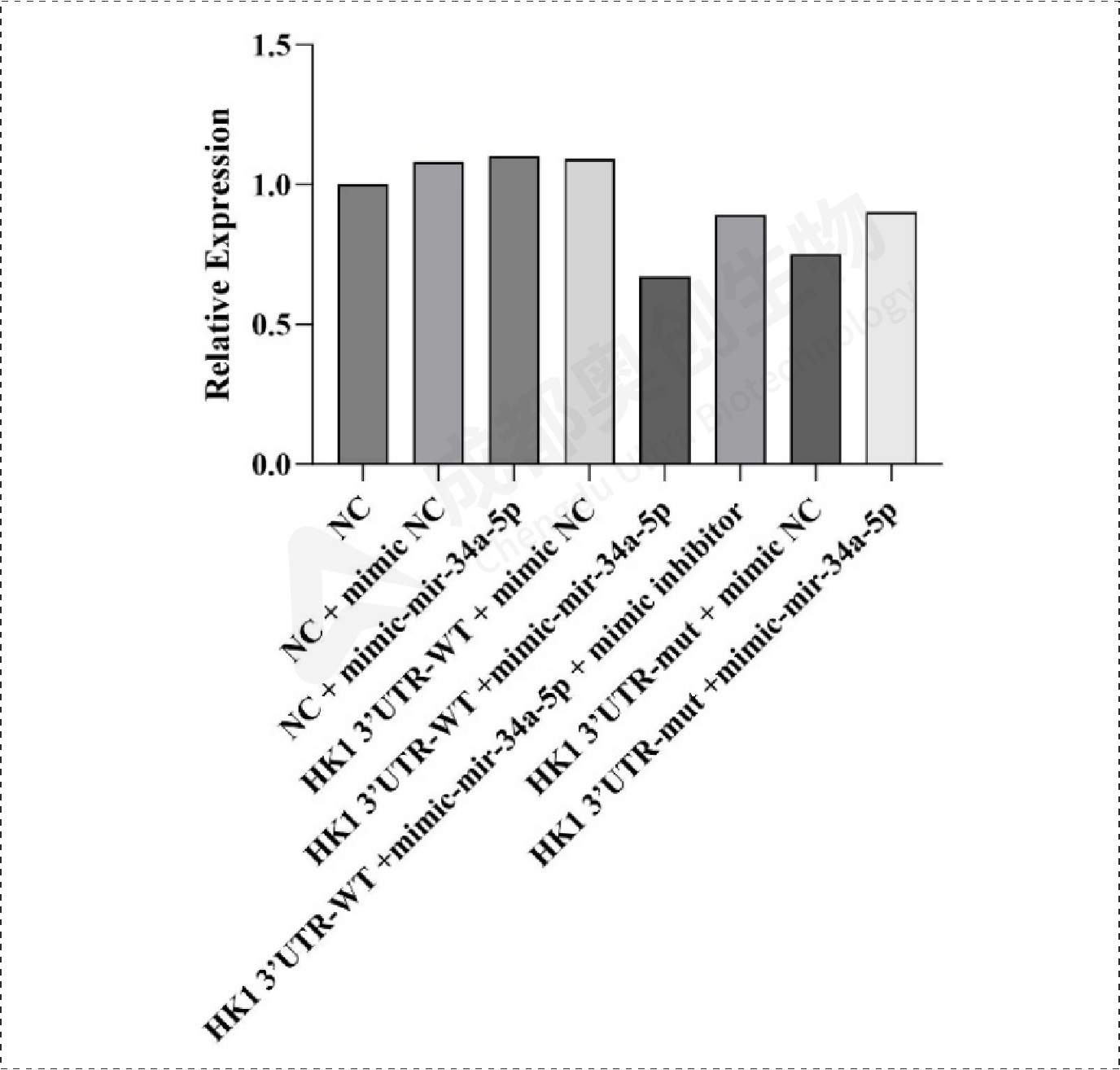
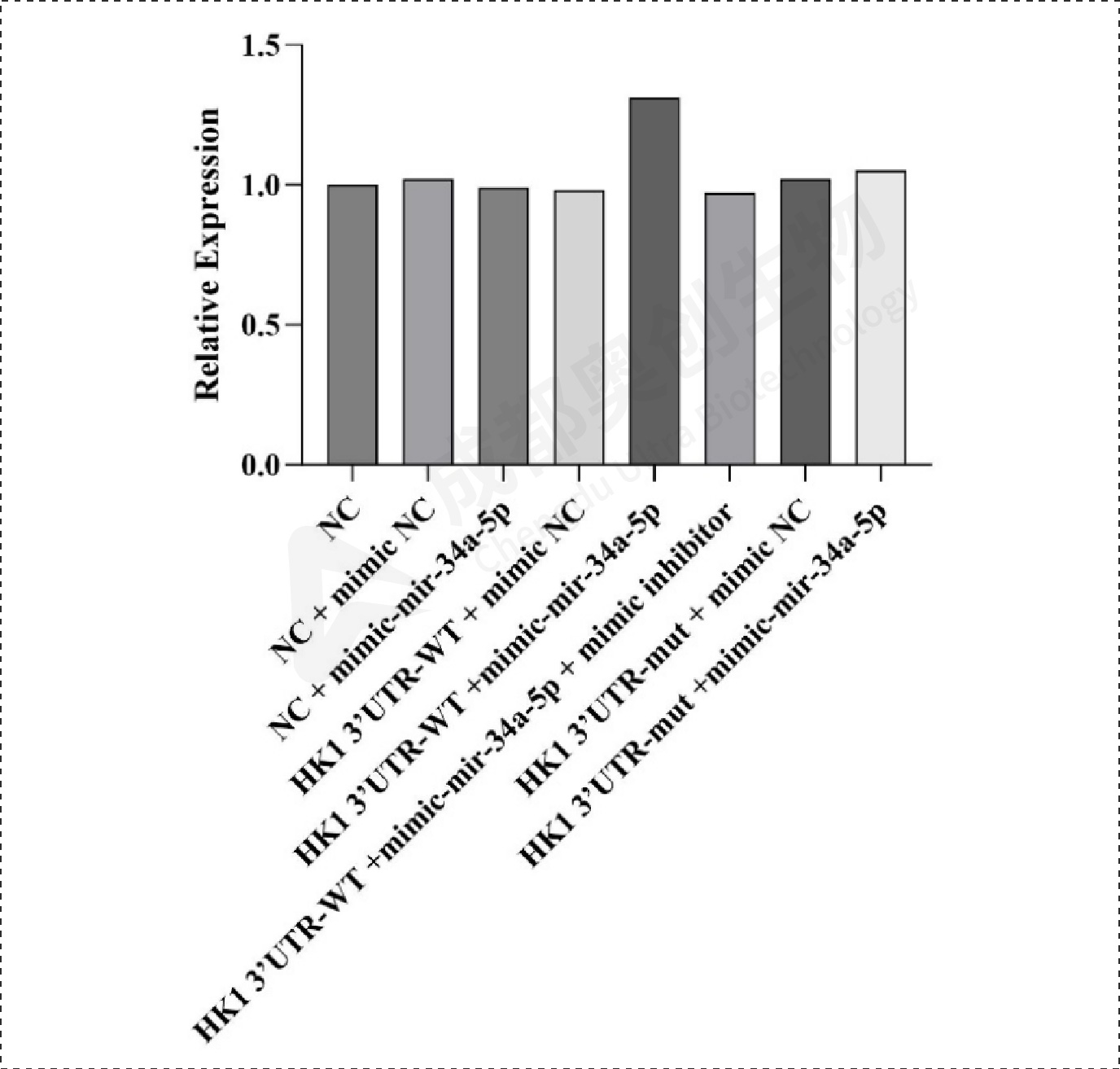
Fig18.HK1相对表达量:
Fig19.加入CDK6 mimic后Bcl2相对表达量:
Fig20.加入SDK2 mimic后Bcl2相对表达量:
Fig21.加入HK1 mimic后Bcl2相对表达量:
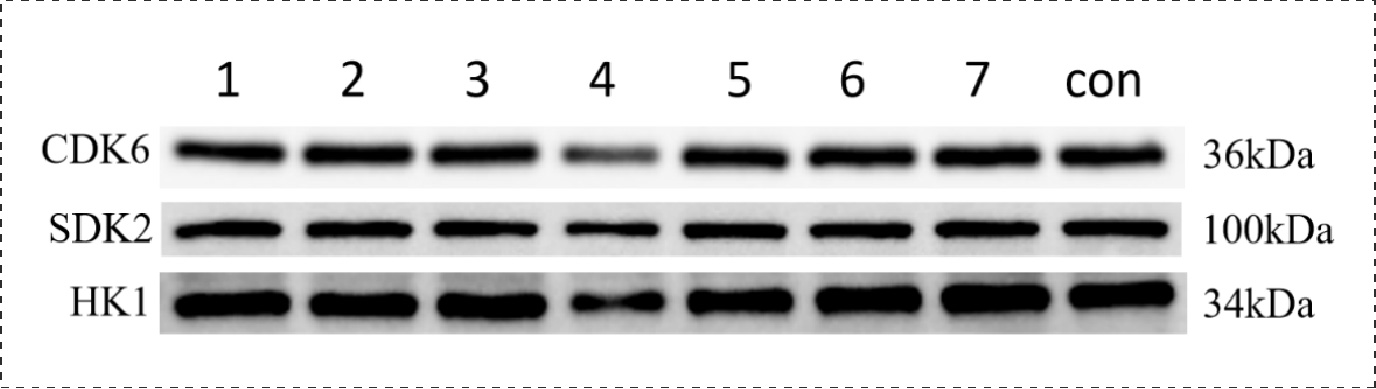
Fig22.转染后的靶蛋白表达情况:
1-NC+NC mimic, 2-NC+mimic-mir-34a-5p, 3-3’UTR-WT+mimic NC, 4-3’UTR-WT+mimic-mir-34a-5p, 5-3’UTR-WT+mimic-mir-34a-5p+inhibitor, 6-3’UTR-mut+mimic NC, 7-3’UTR-mut+ mimic-mir-34a-5p, 8-control
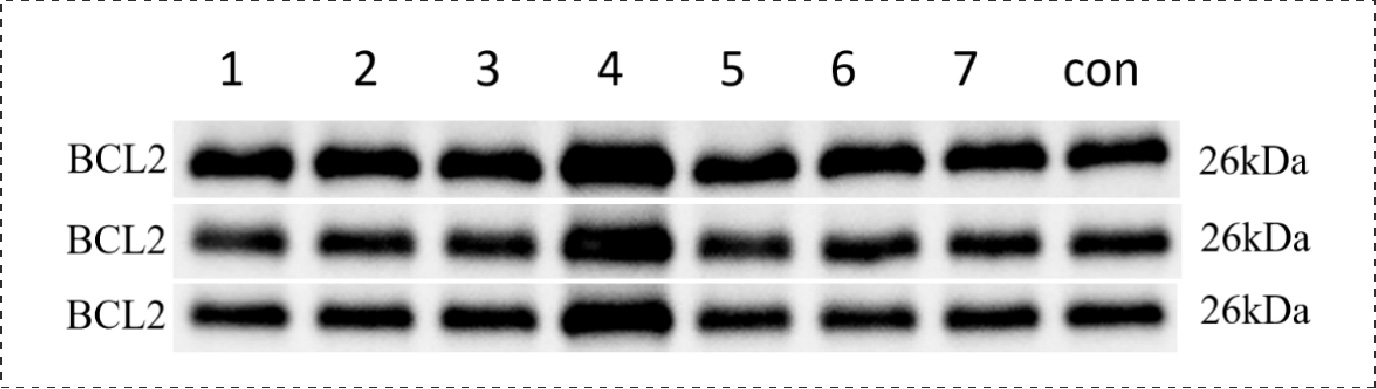
Fig23.转染后的BCl2蛋白表达情况:
1-NC+NC mimic, 2-NC+mimic-mir-34a-5p, 3-3’UTR-WT+mimic NC, 4-3’UTR-WT+mimic-mir-34a-5p, 5-3’UTR-WT+mimic-mir-34a-5p+inhibitor, 6-3’UTR-mut+mimic NC, 7-3’UTR-mut+ mimic-mir-34a-5p, 8-control
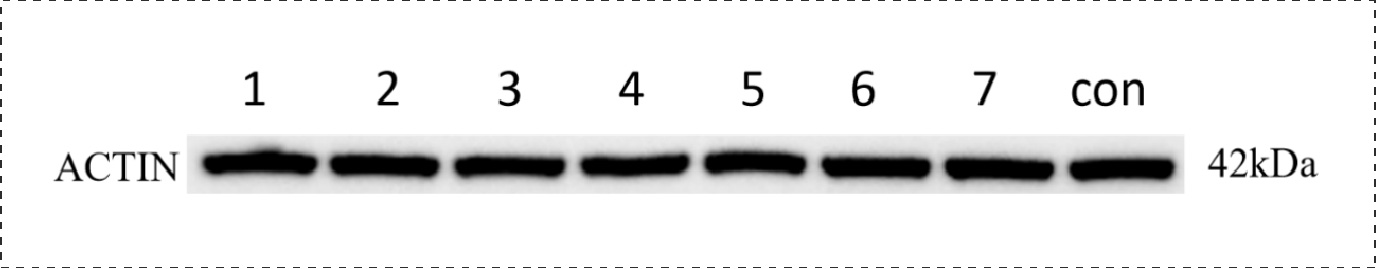
Fig24.内参的表达情况:
通过整体实验,我们预测了mir-34a-5p的靶位点,通过两个预测网站预测到多个靶位点,选取了感兴趣的靶基因进行研究,通过构建双荧光素酶报告基因质粒,检测重组CDK6、HK1和SDK2报告基因的荧光强度,这3个基因的相对荧光强度都下降,后续构建CDK6、HK1和SDK2的表达质粒,通过转染将目的质粒和mimic/inhibitor转到细胞,通过检测CDK6、HK1、SDK2和BCl2在mRNA和蛋白水平上的相对表达量确定mir-34a-5p对CDK6、HK1和SDK2的调控,结果显示mir-34a-5p对CDK6、HK1和SDK2有明显的上调作用,后续对BCl2的检测结果显示mir-34a-5p可能通过对上述基因(CDK6、HK1和SDK2)的调控从而促进凋亡蛋白BCl2的产生从而促进细胞凋亡。