1.1动物饲养环境
KM小鼠,SPF级,20~22g,饲养于奥创生物动物房中,室温22℃~25℃,湿度50%±5%,明、暗各12 h,试验期间小鼠自由摄食和饮水。
1.2实验材料
实验药品:水合氯醛,生理盐水。
实验器材:碘伏,碘伏棉,酒精棉,手术剪,镊子,1mL注射器,缝合针,4-0号缝合线,10mL注射器针头,无菌纱布,去毛器,小鼠固定板。
1.3实验前准备
(1)进行手术前,小鼠禁食12h。
(2)所有实验用具均进行消毒灭菌处理,使用前放置在75%乙醇中。
1.4动物麻醉
手术前腹腔注射水合氯醛对小鼠进行麻醉,给药体积0.1mL/10g,水合氯醛浓度为3%,溶于生理盐水中,现配现用。
1.5造模方法
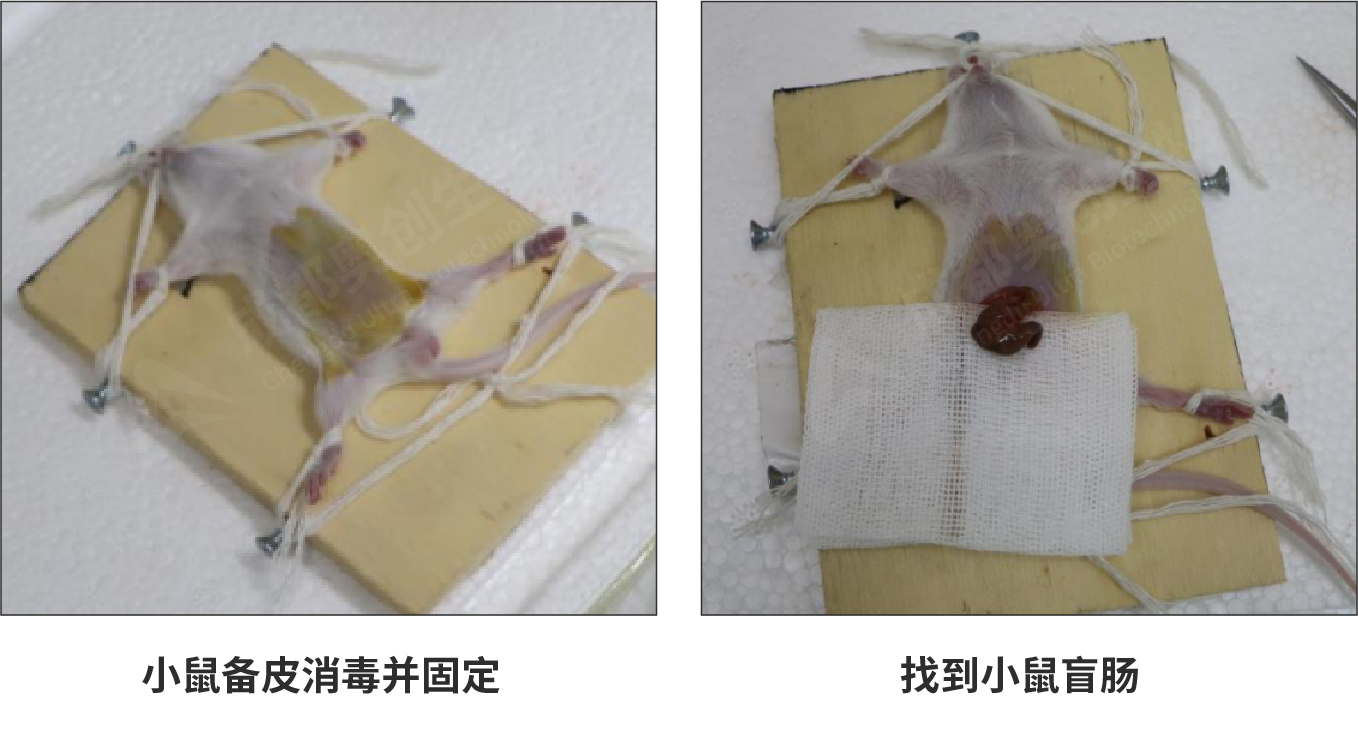
(1)对麻醉后的小鼠下腹部进行备皮,采用俯卧位固定在手术板上,使用酒精棉和碘伏棉对下腹部进行消毒。
(2)使用手术剪沿腹中线逐层剪开皮肤、肌层和腹膜,找到盲肠。
(3)在开口处垫放无菌纱布,用无菌镊取出盲肠放于纱布上,剥离肠系膜。
(4)使用4-0号缝合线在距离盲肠末端1/2或1/3处进行结扎,并采用20G针头对末端盲肠进行穿刺1-2次,并挤出一定量的肠容物。
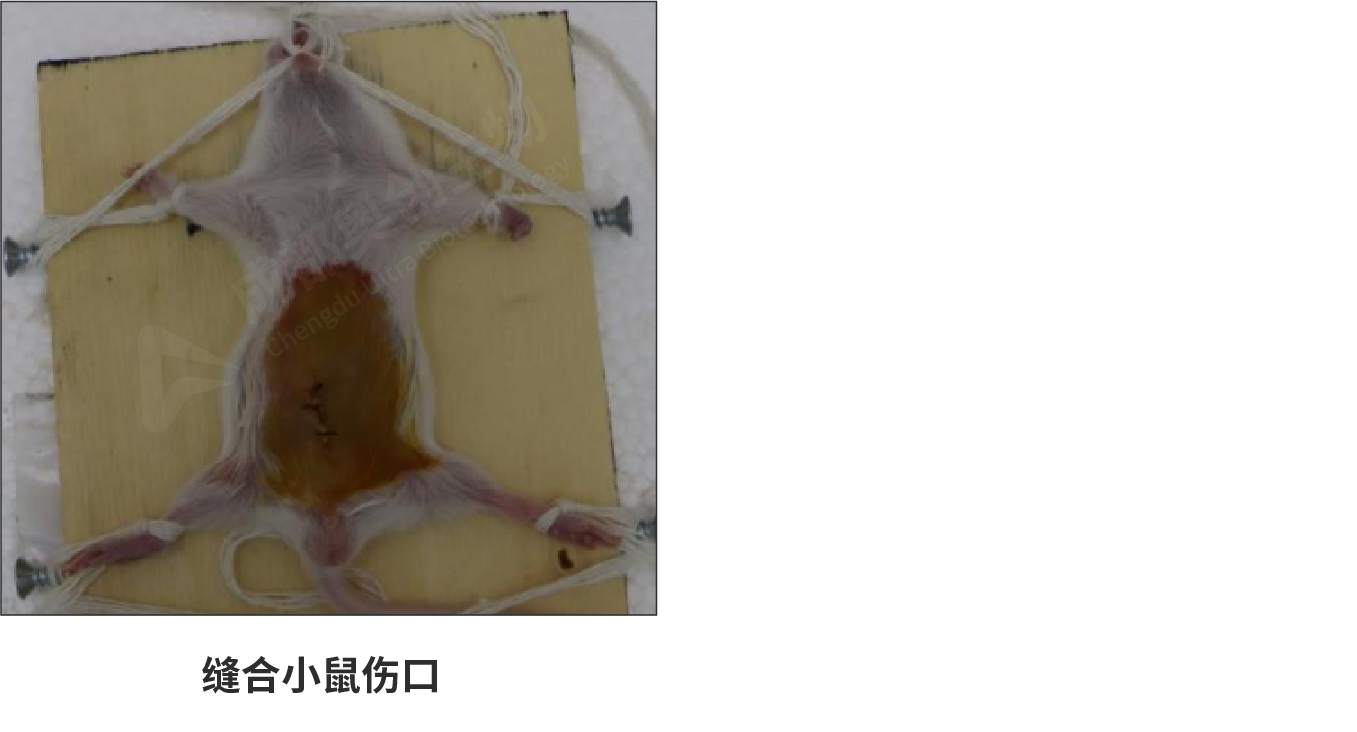
(5)将盲肠放回腹腔中,逐层缝合腹腔,再次使用碘伏消毒。
盲肠结扎穿刺造模流程:
造模24h后,取血,离心后取血清检测ALT、AST含量,取肝、肺、脾、回肠进行HE染色检测。
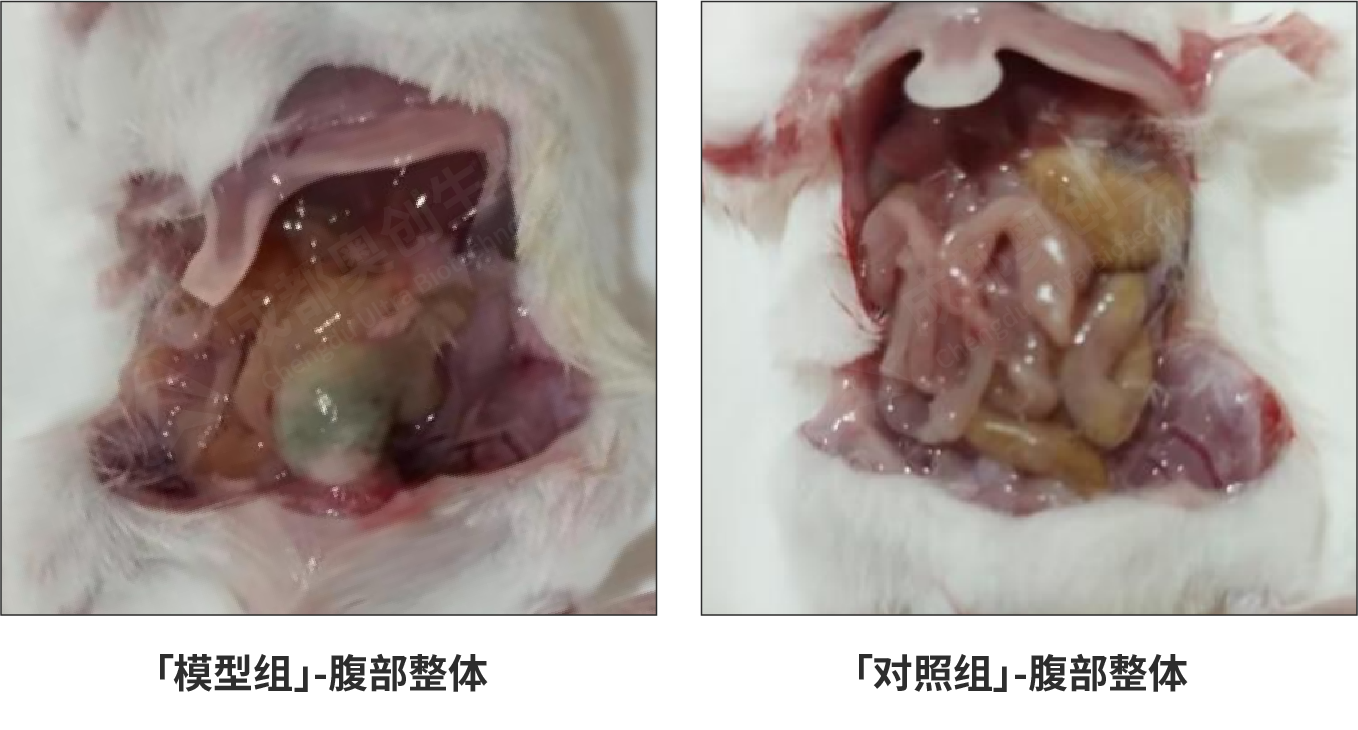
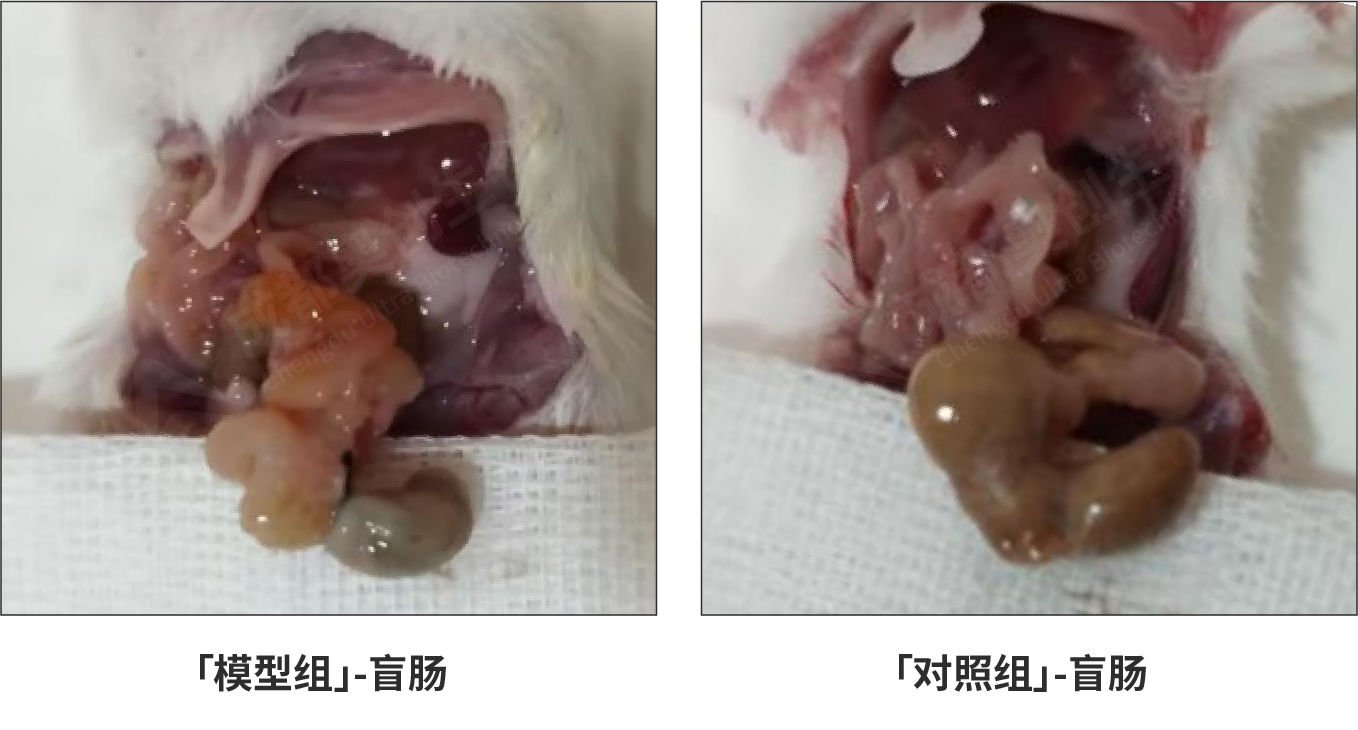
盲肠穿刺结扎24h后解剖对比结果:
盲肠结扎24h后,小鼠出现精神状态不佳、行动缓慢、蜷缩抱团。解剖后模型组肠道粘连,空肠充气,出现明显水肿,盲肠结扎段存在明显的病变。并在解剖时伴随着明显的腐烂气味。
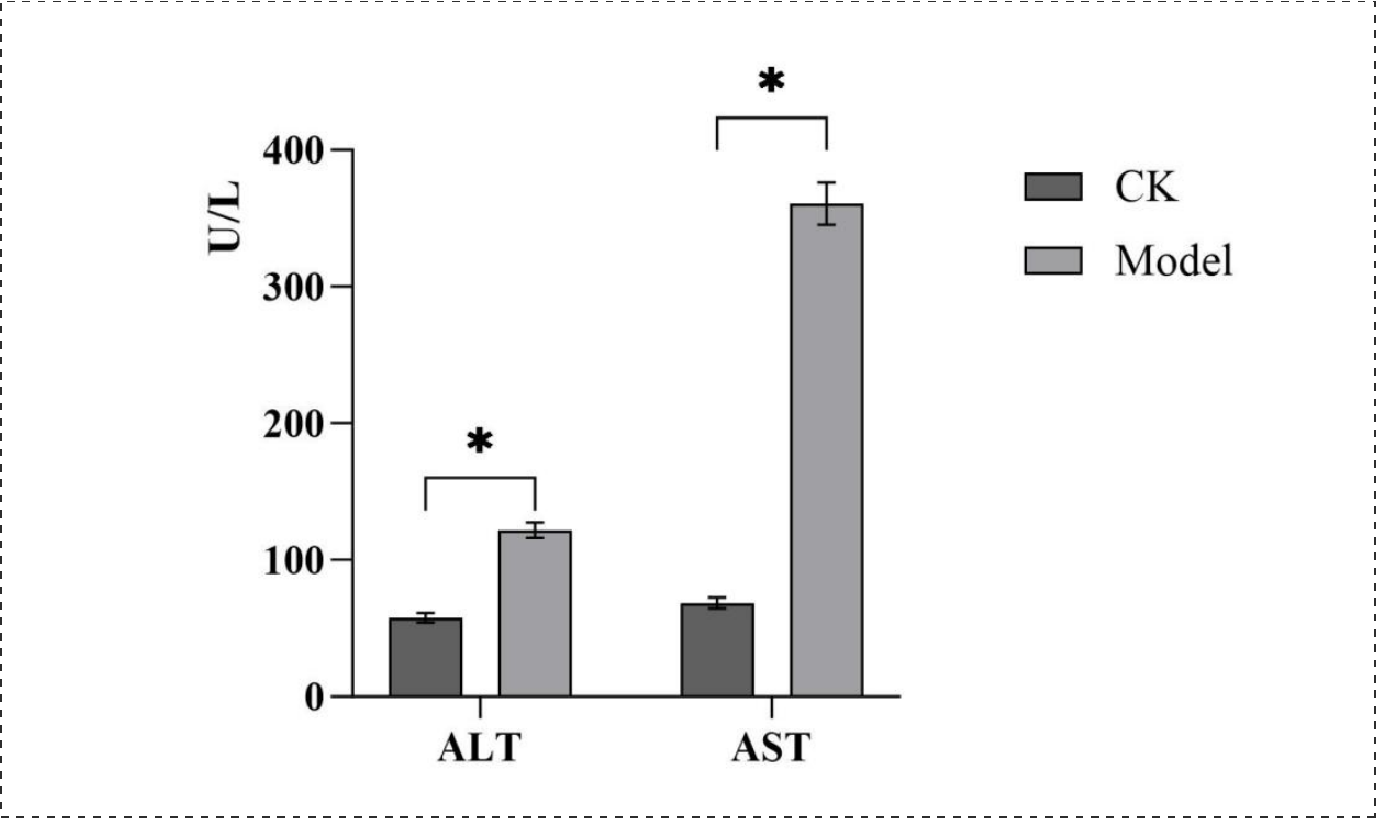
血清中ALT、AST检测结果(血清中ALT和AST含量):
对比发现,小鼠造模24h后,血清中ALT和AST含量显著上升,与对照组存在明显差异。
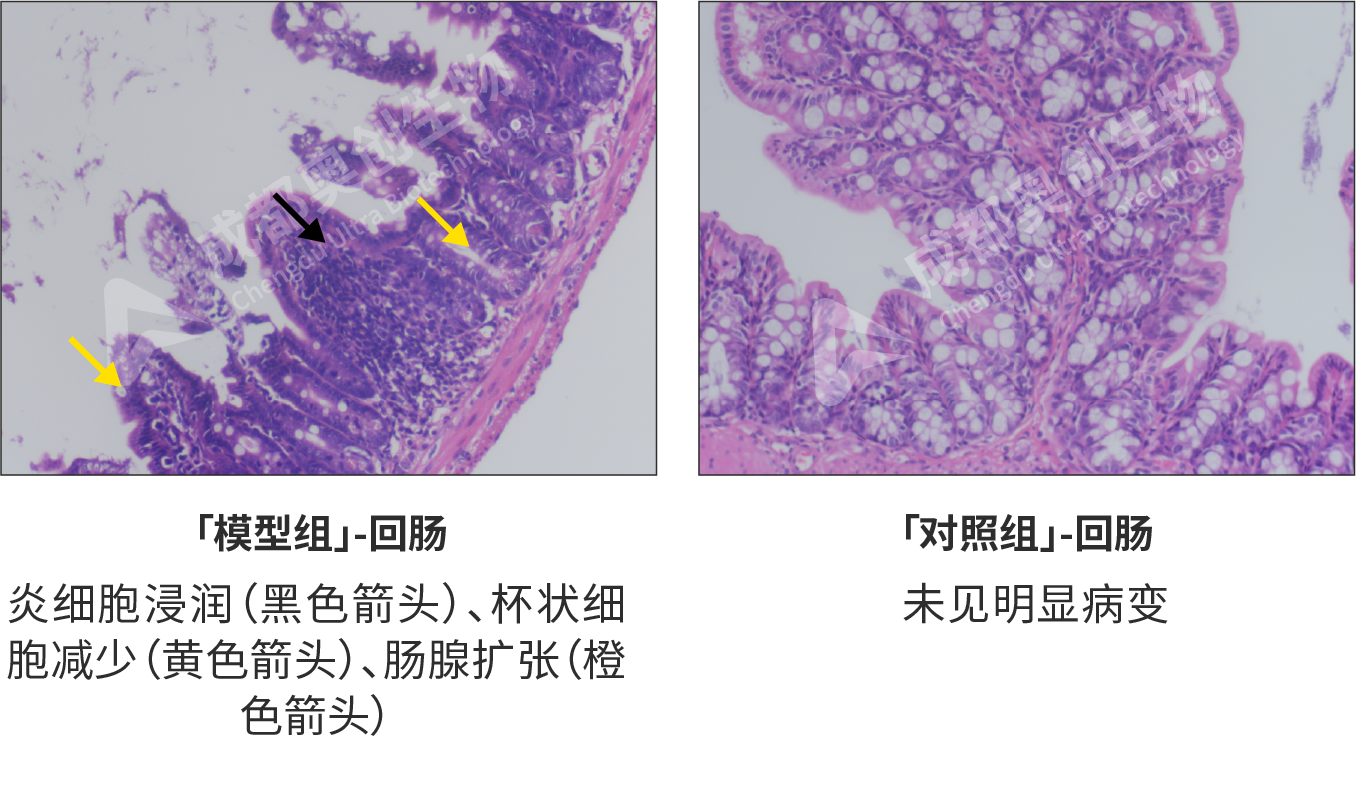
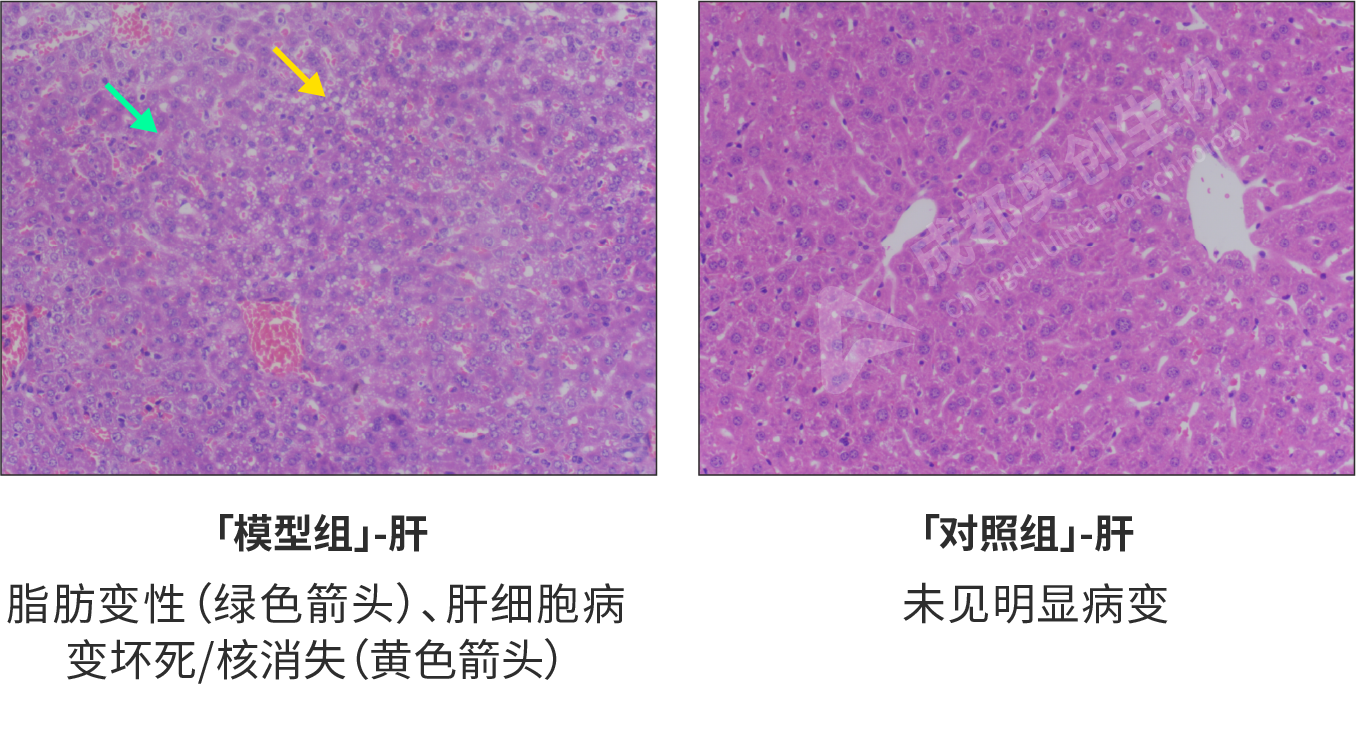
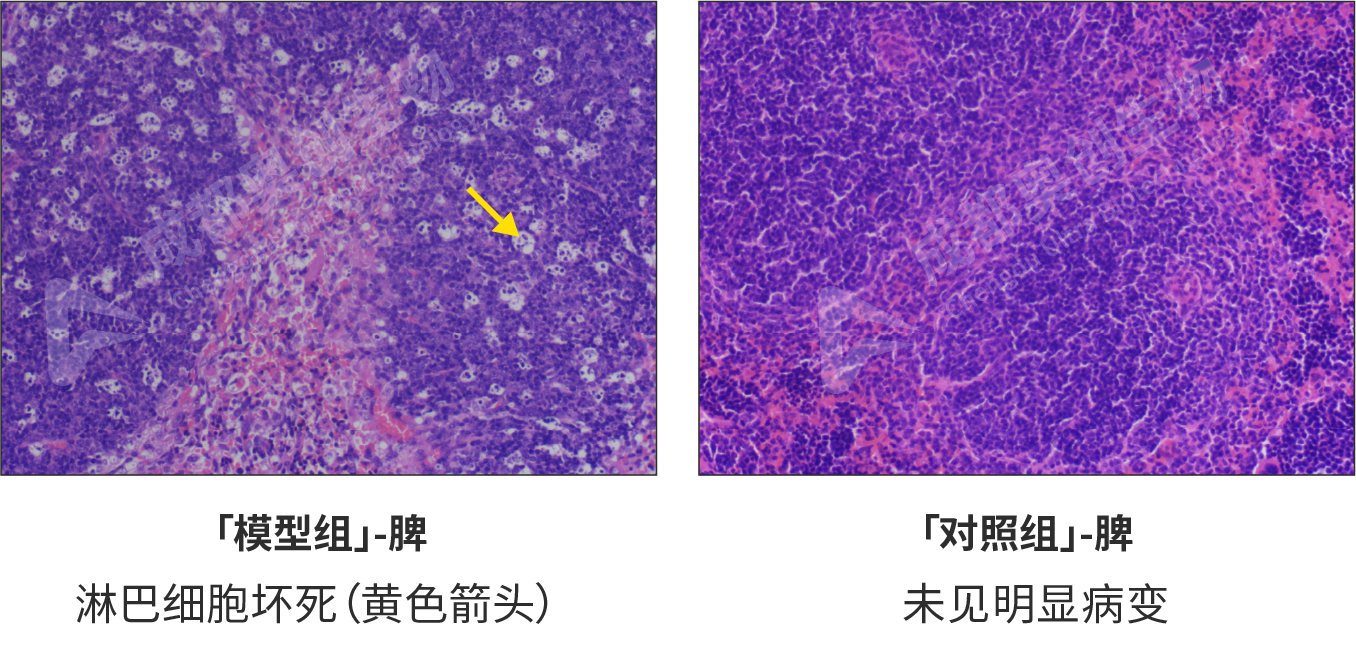
HE染色形态学检测(对不同组织器官的影响(HE,200x):
经病理学检测,模型组病变严重,其中回肠中可见少量炎细胞浸润和肠腺扩张,较少量杯状细胞减少;肺组织出现少量气道壁增厚和炎细胞浸润,较少量肺泡塌陷;肝组织中大量脂肪变性,少量肝细胞病变坏死/核消失;脾脏中较多淋巴细胞坏死。对照组各组织均无明显病变。
实验结论:
通过对小鼠盲肠进行结扎穿刺,血清中肝损伤指标AST和ALT显著上升,且肝、脾、肺和回肠均出现了一定程度的损伤,其中回肠和肺损伤最为明显,表明盲肠结扎穿刺模型能有效诱导全身性炎症,但具体的损伤机制仍需进一步研究。
实验小结:
3.1、术后管理
(1)术后可在背部皮下注射生理盐水1ml,补充手术遗失的体液。
(2)在饲养笼中放置适量泡软的饲料,方便术后小鼠进食。
(3)术后要对动物进行一定的保温措施,避免体温过低。
(4)术后每隔一段时间观察小鼠精神状态和死亡情况。
3.2、注意事项
(1)实验所用器具均要消毒,避免细菌感染。
(2)在开腹和穿刺时应避开血管,避免出血。
(3)术后要多观察小鼠状态,及时发现死亡小鼠。
(4)将盲肠放回到腹腔内,注意不要将盲肠上的粪便扩散到腹壁伤口边缘引起感染。
3.3、模型优化
(1)若想提高模型严重程度,可增大结扎盲肠比例,增加穿刺次数。但死亡率会显著升高。
(2)可在穿刺孔处穿线,留下大于盲肠直径的线圈,引导肠容物持续流出,避免伤口愈合或被封堵。